Introducción
El plomo es uno de los minerales que más ingresos económicos brindan a nuestro país, sin embargo, a pesar de los beneficios que trae esta actividad, debemos enfrentarnos a los perjuicios que causa. Muchos de los pasivos ambientales se generaron en el pasado lejano, en una época en que para la extracción de minerales no existían leyes ni normas ambientales que se encargaran de regular su explotación. Aún hoy en día, estos pasivos ambientales no son controlados de manera adecuada y ocasionan una constante contaminación del medio físico como el agua y el suelo.
El Ministerio de Energía y Minas (MINEM) ha inventariado solo 13 de 65 cuencas en las que hay actividad minera, de modo que su actualización no es completa. Se han medido concentraciones importantes de metales pesados como fierro, cobre, zinc, plomo, cadmio, arsénico y antimonio en zonas afectadas con relaves mineros como Ticapampa [1,2].
En esta investigación se trabajó con relave minero, con el fin de extraer microorganismos de flora micota nativa de un medio contaminado por diversos metales, para aprovechar el potencial que poseen algunas de estas cepas fúngicas de remover o inmovilizar metales pesados a través de la bioabsorción, usando como bioabsorvente la pared celular de su propia biomasa viva o inactiva.
Cabe mencionar que los hongos filamentosos han sido reportados como materiales biosorbentes eficientes de diversos elementos metálicos. Según Volke-Sepúlveda y col. [3] la acumulación de metales en estos microorganismos se da como resultado del transporte activo para propósitos metabólicos y el transporte pasivo y retención de especies químicas por los constituyentes de la pared celular. Recientemente, se ha establecido el potencial de adaptación de algunos micro-organismos en zonas contaminadas con metales pesados y el uso de su biomasa viva o muerta para tratar de eliminarlos de los diferentes nichos acuáticos contaminados. El objetivo de esta investigación fue investigarla capacidad de bioabsorción de plomo de las especies nativas de hongos filamentosos de un relave minero y cuáles de ellas tienen la capacidad de disminuir significativamente la concentración de plomo de un medio acuoso contaminado.
Metodología
Ubicación y acceso al área de estudio
El Pasivo Ambiental Minero de Ticapampa se encuentra ubicado dentro de la Cordillera Negra, distritos de Ticapampa y Aija, Región de Ancash, con altitudes entre los 4100 y 4975 m es uno de los más grandes en extensión en esta zona. Sus dimensiones son: 750 x 200 metros, con una altura máxima de 19 metros, lo que supone alrededor de 5 millones de toneladas métricas de relaves. El depósito presenta varios niveles y sectores que han sido utilizados en forma alternada desde hace más de 50 años por una empresa minera.

Figura 1. Vista frontal del depósito de relave aledaño al Rio Santa, ubicado en la localidad Ticapampa, Distrito de Recuay, Departamento de Ancash.
Toma de muestra y aislamiento de flora fúngica
Prueba de tolerancia al plomo de las cepas fúngicas
Se utilizó AEM contaminado con diferentes concentraciones de plomo (200 ppm, 400 ppm, 800 ppm, 1000 ppm de plomo) en forma de acetato de plomo, en las cuales se inocularon las cepas aisladas. Se dejó incubar a 30 °C durante 11 días. Se midió el diámetro de crecimiento micelial en placa a partir de las 48 horas de incubación.

Figura 2. Izq.: Toma de muestra sólida (punto 2) del depósito de relave Ticapampa- Recuay. Der.: Toma de muestra liquida (punto 5) del depósito de relave Ticapampa (Recuay, Ancash).
Producción de biomasa fúngica viva e inactiva
Para el aumento de biomasa fúngica se usó un inoculo de 1 x 106 esporas en 150 mL de caldo CASO, a pH 4, incubado a 30 °C con agitación de 120 rpm durante 7 días. La biomasa
obtenida se separó del medio por decantación a un tubo Falcon y se centrifugó a 3000 rpm por 5 minutos, se realizaron 3 lavados con agua desionizada estéril. Se secó en la estufa a 70 °C durante 2 horas y luego se pesó una cantidad determinada para su evaluación. Para la obtención de biomasa inactiva, una parte de la biomasa obtenida en los matraces fue tratada en autoclave a 121 °C por 35 minutos.
Determinación del pH óptimo
Se prepararon tres matraces con 200 mL de solución de plomo a 200 ppm, ajustado a pH 4, pH 5 y pH 6, usando ácido nítrico e hidróxido de sodio. Se distribuyeron 10 mL de solución en tubos de polietileno y se añadió 1g/L de biomasa. Se colocó en una incubadora shaker orbital a 30 °C con agitación a 150 rpm durante 72 horas. Se realizó la medición de la concentración de plomo, por el método de absorción atómica, con un equipo espectrómetro de absorción atómica AA800, modelo AS-90, marca Perkin Elmer, por la técnica de flama, usando una lámpara de EDL para Pb, una energía 73 y una longitud de onda de 283.3 nm.

Figura 3. Izq.: Sistema de Incubación en agitación para sorción del plomo Der.: Espectrómetro de absorción atómica AA800 modelo AS-90 marca Perkin Elmer, técnica de flama usando una lámpara de EDL para Pb, energía 73, longitud de onda 283.3 (Laboratorio de Técnicas Analíticas Nucleares de la Dirección INDE-IPEN).
Determinación de la cinética de sorción
Para esta prueba se usó la biomasa muerta (inactiva), se preparó 650 mL de solución a 200 ppm de Pb y se distribuyó 40 mL a tubos de polietileno, se le añadió 1 g/L de biomasa fúngica inactiva y se colocó en la incubadora shaker orbital a 30 °C en 150 rpm durante 72 horas. Posteriormente, se extrajo una alícuota en los siguientes tiempos de incubación:
Tiempo
0 horas
1 hora
2 horas
3 horas
6 horas
24 horas
48 horas
72 horas
Alícuota
5 ml
5 ml
5 ml
5 ml
5 ml
5 ml
5 ml
5 ml
Identificación molecular de las cepas con mayor capacidad de sorción de plomo
Extracción de ADN
Se pesaron 300 μg de biomasa molida con nitrógeno líquido en microtubos de 1.5 mL. Se agregaron 700 μl de Buffer de extracción (TrisHCl pH = 7.2, 50 EDTA, SDS y 2- mercaptoetanol) a cada microtubo adicionando 2-mercaptoetanol al 1 % del volumen a trabajar al momento. Se llevó al vórtex por 2 minutos y se incubó a 65 °C por 1 hora. Luego, se agregaron a cada microtubo 600 μl de CHCl/alcohol isoamílico (24:1), se mezcló por inversión y se centrifugó a 14000 rpm a 4 °C por 10 minutos. Se recuperó el sobrenadante de cada microtubo y se trasladó a uno nuevo. Posteriormente, se adicionó a cada microtubo
0.5 volúmenes de Buffer Acetato de sodio pH=5.8, se mezcló por inversión y se refrigeró a 4 ºC por 30 minutos. Posteriormente, se centrifugó a 14000 rpm por 10 minutos y se recuperó el sobrenadante. Se agregaron a cada microtubo 2 volúmenes de isopropanol, se mezcló por inversión y se refrigeró a -20 °C por una hora. Se centrifugó a 14000 rpm por 10 minutos, se descartó el sobrenadante y el pellet fue lavado con 500 μl de etanol al 70 %, se centrifugó a 14000 rpm por 10 minutos, el sobrenadante fue descartado. El pellet obtenido se secó a temperatura ambiente y se eluyó en 20 μl de buffer (10 mM TrisHCl pH=8.2). Se colectaron todas las repeticiones de una misma muestra en un solo microtubo y finalmente, se agregaron 15 μl de RNAsa (10 mg/mL) a cada microtubo y se incubó a 37 °C por 15 minutos.
Análisis cualitativo
Se realizó electroforesis horizontal en gel de agarosa con tampón de corrida TAE 1X y se agregó 1 % de una solución de bromuro de etidio 5 μg/mL en el gel. Se utilizó como marcador de peso el fago lamba digerido con Hind III, se cargó el pozo con 1 μl de marcador, 4 μl de agua destilada estéril y 1 μl de tampón de carga. La corrida se realizó a 90 V por 60 minutos y, posteriormente, el gel se llevó al documentador de imágenes para capturar la imagen y evaluar el tamaño de bandas.
Análisis cuantitativo.
Se leyeron las absorbancias de las muestras de ADN extraídas en el dispositivo NanoDropTM a 260, 230 y 280 nm. El grado de pureza se obtuvo de las relaciones entre las absorbancias a 260, 230 y 280 nm de cada muestra.
Amplificación de genes de diversidad mediante PCR
Se preparó la mezcla inicial para cada reacción de amplificación de la siguiente manera: Se utilizaron 4 μl de Buffer de PCR 1X, 2 μl de MgCl2 2.5 mM, 1 μl de dNTP mix, 1 μl de cebador Forward y Reverse a 0.5 μM, 0.15 μl de GoTaq 1U, 4μL de ADN a un volumen final de 20 μl. Se programó el termociclador S1000 (BioRad) utilizando los siguientes parámetros de amplificación: Desnaturalización inicial a 95 °C por 5 minutos, Desnaturalización (95 °C por 1 minuto), Alineamiento (57 °C), Extensión (72 °C) por 30 ciclos y Extensión final a 72 °C. Los cebadores utilizados para amplificación fueron obtenidos de acuerdo al trabajo de Visagiey col. 2014 [4].
Análisis filogenético
Los productos de amplificación fueron enviados a Macrogen Inc. (Seúl, Corea del Sur) para secuenciamiento. Las secuencias obtenidas fueron leídas y editadas en BioEdit 7.2.5, estas secuencias fueron comparadas por el buscador BLASTN con la base de datos del NCBI GenBank. El análisis filogenético fue llevado a cabo con el programa MEGA 6 usando el método neighbor-joining con 1000 bootstraps.
Resultados
Aislamiento de flora fúngica tolerante al plomo
Fueron seleccionadas cinco cepas fúngicas a partir de la muestra de relave, que crecieron favorablemente a la presencia de plomo en medio ácido, con características morfológicas diferentes.

Tabla 1. Se indican los incrementos, en centímetros, de los diámetros de crecimiento durante 11 días de evaluación. Durante esos 11 días los cultivos fueron incubados a 30 ºC.
Control
200
ppm Pb
400
ppm Pb
600
ppm Pb
800
ppmPb
1000
ppm Pb
Cepa 01M
7.8
7.6
6.9
5.7
5.4
4.7
Cepa 02M
7.5
7.3
6.8
6.0
5.2
4.7
Cepa 03M
5.75
5.6
4.85
4.55
3.75
2.4
Cepa 04M
5.8
5.2
5.3
5.3
5.1
4.2
Cepa 07M
7.7
7.2
6.1
4.9
4.3
3.0
Análisis de tolerancia al plomo mediante medición del diámetro de crecimiento en medio agarizado
En la Tabla 1 se indican los valores de crecimiento obtenidos de las mediciones del diámetro micelial en placa durante 11 días de incubación.
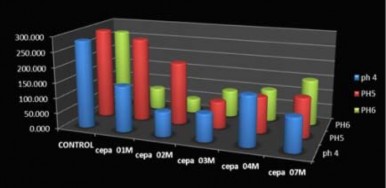
Figura 5. Capacidad de bioabsorción de biomasa muerta en función del pH de la solución según la concentración del metal. El Pb se extrajo a 30 °C y 150 rpm durante 24 h.
Determinación del pH óptimo de sorción de plomo para biomasa inactiva
El pH óptimo fue aquel en el cual hubo la mayor disminución de concentración del plomo inicial en el medio. Las cepas 01M, 02M y 04M hicieron la mayor remoción de plomo a un pH 6, seguida por la cepa 03M con mayor remoción a pH 5 mientras que el pH óptimo para la cepa 07M fue de 4.
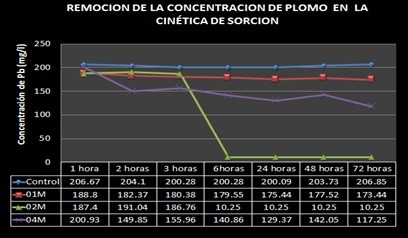
Figura 6. Capacidades de biosorción de Pb por biomasa muerta (1 g/L) de 03 cepas de hongos filamentosos con eficacia de bioabsorción de plomo.
Cinética de bioabsorción de plomo
En la Figura 2 se muestra la disminución de la concentración de plomo en el medio en un rango de 0 a 72 horas de contacto en proporción al tiempo. La mayor capacidad de biosorción corresponde a la cepa 02M, con una sorción de 190.15 mg/L de plomo a partir de las 6 horas de contacto, manteniendo la cantidad de plomo retenido hasta las 72 horas, seguido de la cepa 04M con 86.48 mg/L de plomo a partir de las 2 horas de incubación; la cepa 01M logró remover 29.33 mg/L de plomo.
3.5 Identificación molecular de las cepas con mayor capacidad de biosorción de plomo
En los cuadros siguientes se muestran los resultados obtenidos en la identificación molecular de las cepas de hongos con mayor eficacia en bioabsorción de plomo (01M, 02M y 04M), mediante comparación de las secuencias de las regiones BT2 y CMD. A partir de las cepas que fueron identificadas a nivel de especie se construyeron Árboles Filogenéticos de cada cepa identificada.
Tabla 2. Detalles de la identificación molecular de las cepas de hongos con mayor eficacia de bioabsorción de plomo.
Código
Cebadores
Tamaño de Secuencia (bp)
Identificación NCBI
%
Cobertura
%
Identidad
Accesión
IPEN_001M
Bt2_f
512
Talaromyces flavus
voucher
BYD07‐13 beta‐ tublin gene, partial cds
100
99
KF917584.1
Bt2_r
CMD5_f
601
Talaromyces flavus
voucher
BYD07‐13 beta‐ tublin gene, partial cds
100
99
KF917585.1
CMD6_r
IPEN_002M
Bt2_f
520
Talaromyces muroii
strain CBS
756.96 beta‐tubulin (tub2)
gene, partial cds
100
100
KJ865727.1
Bt2_r
CMD5_f
326
Talaromyces muroii
strain CBS
756.96 calmodulin (CmdA)
gene, partial cds
100
99
KJ885274.1
CMD6_r
IPEN_004M
Bt2_f
555
Penicillium velutinum strain
NRRL2069 beta‐ tubulin gene, Partial cds
100
100
JX141170.1
Bt2_r
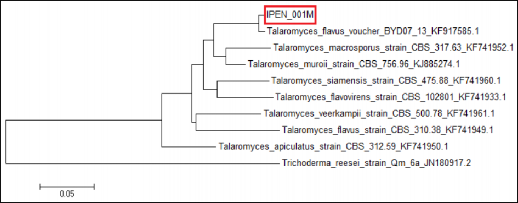
Figura 7. Árbol filogenético de la cepa IPEN_001M usando cebadores CMD.
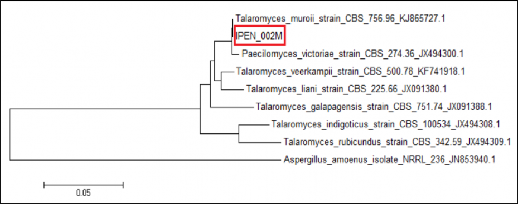
Figura 8. Árbol filogenético de la cepa IPEN_002M usando cebadores CMD.
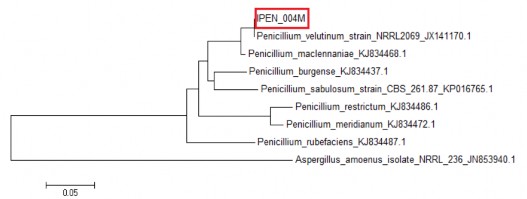
Figura 9. Árbol filogenético de la cepa IPEN_004M usando cebadores CMD.
Discusión
El número de cepas tolerantes al plomo aisladas coincide con algunos reportes de la literatura sobre aislamientos a partir de desechos mineros [5]. Las cepas evaluadas presentan crecimiento óptimo hasta 400 ppm de plomo; a mayor concentración se observa inhibición; sin embargo, Cárdenas J. y col. [6] reportaron hongos filamentosos del género Penicilium y Aspergillus que pueden resistir hasta 2000 ppm de plomo. La biomasa inactiva presenta cantidades similares a la sorción con biomasa viva. Para el proceso de bioabsorcion se evaluó la biomasa inerte ya que según Ahluwalia y Goyal [7] el uso de biomasa muerta permite estimar la cantidad del metal que se acumula en la biomasa de forma pasiva (adsorción). Los valores de pH óptimo coinciden con los reportados en el trabajo realizado por Hernández, 2011 [8] en donde la mayor capacidad de biosorción en biomasa inactiva por ambas cepas se obtuvo a pH 6. Otros estudios como el de Say y col., 2001 [9] y Akar y Tunali, 2006 [10] indican que a pH cercano a 6 se alcanzan las máximas capacidades de biosorción de iones metálicos, como Cd2+, Pb2+ y Cu2+, en biomasa inactiva de algunas especies como Phanerochaete chrysosporium y A. flavus. Así mismo, Yan y Viraraghavan en 2003 [11], determinaron que la capacidad de biosorción de iones de Pb2+, Zn2+, Cd2+ y Ni2+ en biomasa muerta de Mucor rouxiise incrementaba a pH 6.
Ahluwalia y Goyal [7] reportaron que el uso de biomasa muerta permite estimar la cantidad del metal que se acumula en la biomasa de forma pasiva (absorción). Con el objetivo de evaluar el efecto de la biomasa inactiva en la biosorción de Pb, se determinó la capacidad de biosorción a partir de biomasa muerta o inactiva considerando el pH óptimo obtenido en análisis anterior. Si se compara la capacidad de biosorción de Pb por biomasa inactiva obtenida en este estudio con resultados publicados por Hernández, S. en 2011[8] puede decirse que las biomasas de las cepas 01M, 02M y 04M podrían considerarse como un biosorbente efectivo para la remoción de Pb a partir de soluciones diluidas, ya que según Ahluwalia y Goyal, 2007 [7] y Wang y Cheng, 2009[12] , los valores de biosorción hallados se encuentran dentro del rango adecuado para tal propósito. Las diferencias en la bioabsorción pueden deberse a cambios no conocidos en los componentes de la pared celular de los hongos pues se han reportado diferencias en la exposición de sitios de la pared celular con afinidad por metales aún en las mismas especies [12,13].
Conclusiones