Introducción
El cáncer de tiroides es la neoplasia endocrina más común con una incidencia creciente en todo el mundo en las últimas décadas [1]. Histológicamente se pueden clasificar en cáncer papilar de tiroides, folicular o anaplásico. Los cánceres diferenciados de tiroides, presentan evidencia de
diferenciación de células epiteliales foliculares, tales como la captación de yodo, organificación y por lo general son tratados con éxito mediante la extirpación quirúrgica primaria, la terapia con yodo radioactivo y la supresión con levotiroxina. El cáncer papilar de tiroides es el tipo más común en los pacientes y representan el 80 al 90 % los casos. En términos generales, el cáncer de tiroides bien diferenciado es una enfermedad con una tasa de supervivencia global a 5 años en el 97.3% de los casos y una tasa de mortalidad ajustada por edad de 0.5 por cada 100.000 personas. A pesar de este buen resultado y la baja mortalidad relacionada con la enfermedad, los pacientes pueden presentar recurrencia hasta en un 35 %, causando un aumento de la morbilidad relacionada con la enfermedad durante unos 40 años de seguimiento. En el reporte de cáncer de Lima Metropolitana se menciona que el cáncer de tiroides representa el cuarto lugar de neoplasias en mujeres, teniendo una adecuada respuesta a las dosis recibidas sea como ablación o terapia al Yodo 131, radionúclido producido en el Perú [2]. El objetivo del presente trabajo es reportar los casos tratados con yodo radiactivo durante el período de enero de 2012 a marzo de 2013, atendidos en el Instituto Nacional de Enfermedades Neoplásicas (INEN) y en el Centro de Medicina Nuclear del Instituto Peruano de Energía Nuclear (IPEN), describiendo sus características clínicas, dosis de ablación, terapia y riesgo de recurrencia.
Metodología
Se establecieron como criterios de inclusión los siguientes:
Cáncer diferenciado de tiroides, con estudio anátomo patológico disponible.
Tamaño tumoral mayor a 4 cm.
Datos completos sobre el paciente en la historia clínica y disponibilidad de información clínica en los archivos del Centro de Medicina Nuclear (CEMN).
Cáncer papilar o folicular de tiroides.
Tiroglobulina sérica mayor a 4 µg/100 mL en el momento de la administración del yodo radiactivo.
Los criterios de exclusión fueron:
Otras histologías de neoplasias de la tiroides.
Tamaño tumoral menor a 4 cm.
Ausencia de información clínica en el CEMN o en la historia clínica.
Tiroglobulina sérica menor a 4 µg/100 mL en el momento de la administración del yodo radiactivo.
Los criterios de riesgo de recurrencia se tomaron de acuerdo a las guías de la American Thyroid Association (ATA) 2009 [3].
Tabla 1. Características clínicas y patológicas de los pacientes tratados con yodo 131.
Variables
Número (%)
No total de pacientes
37
Edad (años) promedio ± DS
47.43 ± 13.35
Rango
[18‐76]
Mediana
50
2:45
25 (67.6)
<45
12 (32.4)
No de niños (edad::;18)
1 (2.7)
Sexo (razón masculino / femenino 1:4.3)
Masculino
7 (18.9)
Femenino
30 (81.1)
Histología
Papilar
25 (67.6)
Papilar + variante folicular
10 (27.0)
Folicular
1 (2.7)
Papilar + variante esclerosante difusa
1 (2.7)
Compromiso de ganglios linfáticos
Si
22 (59.5)
No
2 (5.4)
NR
13 (35.1)
Sitio de metástasis
Sin metástasis
27 (73.0)
Pulmón
6 (16.2)
Mediastino
3 (8.1)
Pulmón + hueso
1 (2.7)
NR: no registra.
En la Tabla 1 se muestra las principales variables del estudio, entre ellas las edades de los 37 pacientes que tienen una edad promedio de 47.43 años (rango, 18 a 76 años), con el 50 % de casos con edades por debajo de 50; 25 (67,6 %) pacientes con edades mayores o iguales que 45 y 12 (32,4 %) con edades menores a 45 años; un paciente fue niño (2,7 %). Siete (18,9 %) pacientes fueron hombres y 30 (81,1 %) mujeres, siendo la razón masculino a femenino de 1 a 4,3. El tipo histológico más frecuente fue el papilar en 25 pacientes (67,6 %). Hubo 22 (59,5 %) casos con compromiso de ganglios linfáticos. Seis pacientes (16,2 %) con metástasis pulmonar, 3 (8,1 %) con metástasis en el mediastino y 1 (2,7 %) con metástasis pulmonar y ósea.
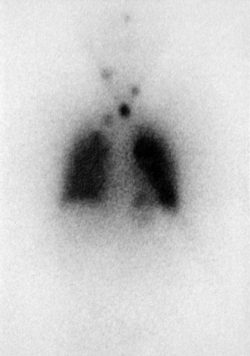
Figura 1. Varón de 28 años, con cáncer papilar de tiroides variante folicular operado, medianamente diferenciado con alto riesgo de recurrencia, que presenta metástasis pulmonar bilateral, con captación difusa en ambos campos pulmonares en el rastreo posterior al tratamiento con 150 mCi de Yodo 131.
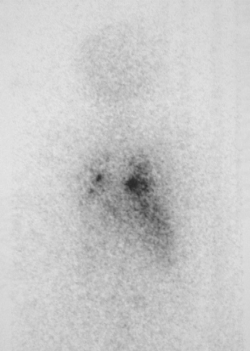
Figura 2. Mujer de 62 años, con carcinoma papilar de tiroides poco diferenciado que recibió una primera dosis de Yodo 131 de 100 mCi, que recibe 180 mCi de Yodo 131 en la segunda dosis y presenta captación pulmonar y ósea. La paciente tenía dosaje de tiroglobulina >1000. Su último control ha sido el 30.11.2015 con persistencia de enfermedad.
Resultados y Discusión
El cáncer de tiroides es una neoplasia cuyo número de casos está en aumento, ya sea por mayor acceso de la población a un adecuado examen clínico y/o por la mejora tecnológica de los exámenes auxiliares de imágenes y por factores de riesgo asociados [1,3,4]. En el presente trabajo la edad promedio fue de 47 años lo que coincide con lo reportado en la literatura [4]. El ultrasonido continúa siendo la modalidad de detección más utilizada en estos casos [5].
El yodo radioactivo tiene una presencia importante tanto en el diagnóstico como en la ablación de restos tiroideos y en la terapia de enfermedad a distancia [5]. En los últimos años su utilidad ha evolucionado hacia un uso selectivo para pacientes con riesgo intermedio y alto de recurrencia. Esta recomendación ya era parte de las guías de la ATA en el año 2009 y se ha reforzado en las guías del 2015 [3,5].
De los 37 pacientes estudiados hay una preponderancia del sexo femenino, lo que coincide con la literatura [3]. La histología de los casos revisados corresponde a carcinoma papilar en el 98% de los casos, similar a lo reportado por la American Cáncer Society en estudios masivos [5].
Las guías de la ATA se han validado en diferentes grupos de pacientes a nivel latinoamericano. En el Perú se está adecuando el Consenso de la ATA y el Acuerdo Intersocietario Latinoamericano para el manejo de estos pacientes. Las recomen-daciones de dichos consensos y guías permiten dar una terapia de tipo estandarizado en cada centro hospitalario [6].
En el estudio los pacientes presentaron solo enfermedad loco regional en 5 casos (13 %), por lo que se les administró una dosis fija de 80 mCi, lo que era recomendado y estandarizado de acuerdo con las guías de la ATA del 2009 [3]; el criterio en este caso fue ablación de restos tiroideos. Este mismo criterio se siguió con dosis de 100 mCi en los otros pacientes de riesgo intermedio sumando en total 10 casos. Siguiendo las recomen-daciones del Acuerdo Intersocietario Latinoamericano y Consenso de la ATA 2009 y 2015 se continúa teniendo este mismo enfoque [7,8].
Se tuvo metástasis a distancia en 10 pacientes, los que correspondieron a alto riesgo de recurrencia y recibieron dosis que estuvieron entre 100 – 180 mCi. Los 3 pacientes que recibieron dosis de 180 mCi de Yodo 131 correspondían a metástasis a pulmón y huesos y habían recibido dosis previas menores.
El manejo actual de los pacientes de riesgo intermedio y riesgo alto continúa siendo complejo y requiere un estudio multidisciplinario; esto coincide con las recomen-daciones de la Clínica Mayo. En una revisión de 1999 al 2006 ellos trataron con un enfoque interdisciplinario y conservador a 420 pacientes utilizando Yodo 131en el 40 % de los casos [7].
En el Perú se tiene la ventaja de contar con la producción local de Yodo 131 de modo permanente en condiciones de costo asequible y con buenas prácticas de manufactura. Se cuenta con la supervisión constante del Organismo Internacional de Energía Atómica tanto en la producción del isótopo como en la renovación y mantenimiento de las celdas de producción [8].
En el futuro se espera poder tratar a más pacientes en forma ambulatoria, en especial a aquellos con riesgo intermedio de recurrencia. Esto podrá lograrse si se individualiza el tratamiento y se consideran factores socio-económicos y geográficos, lo que no se consigue en muchos casos [9].
En los pacientes estudiados se han presentado en el 16 % de casos con captación en los pulmones, lo que continúa siendo una localización frecuente de metástasis por cáncer diferenciado de tiroides [10]. Estos pacientes en el curso de su enfermedad pueden permanecer sin síntomas o avanzar de una manera desfavorable en periodos muy cortos; es por eso, que requieren un seguimiento más frecuente, lo que podría ser motivo de trabajos posteriores [11].
Conclusiones
El Yodo-131 sigue siendo una herramienta vital en el manejo de pacientes con cáncer diferenciado de tiroides.
La presencia de un porcentaje significativo de pacientes con metástasis a distancia hace que sea mandatorio un manejo multidisciplinario; esto será motivo de futuras investigaciones.