Lenin Rueda1, Jaime Rosales1, Kety León2, Marco Espinoza2
1Centro Nacional de Salud Ocupacional y Protección del Ambiente para la Salud (CENSOPAS), Instituto Nacional de Salud (INS).
2Laboratorio de Citogenética y Radiobiología, Instituto Peruano de Energía Nuclear (IPEN).
Se probó la idoneidad del ensayo cometa alcalino para detectar niveles de daño radioinducido en el ADN de linfocitos y monocitos humanos. Para este propósito se construyó cuatro curvas dosis-efecto a partir de la irradiación de células extraídas de la sangre de cuatro donantes jóvenes, sanos y no fumadores. Se usó una fuente de rayos gamma de 60Co y se administraron dosis de 0, 2.5, 5 y 7 Gy. Los resultados muestran una correlación aceptable entre las dosis de radiación y el daño radioinducido en el ADN (R2 = 0.973, SD = 0,009) de acuerdo con el parámetro Tail Intensity (porcentaje de ADN en la cola del “cometa”). Además, se observó la variabilidad en la predicción de daño en el ADN por Gy (7.59, SD =1.5). Se evalúa esta técnica para sus posibles aplicaciones en la dosimetría biológica de las radiaciones ionizantes.
Palabras clave: Ensayo cometa alcalino; Efectos biológicos de las radiaciones; Daños en el ADN; Dosis de radiación; Radioinducción
The suitability of the alkaline comet assay to detect levels of DNA damage in human monocytes and lymphocytes under radiation was tested. For this purpose, four dose-effect curves by irradiation of cells isolated from blood samples of 4 young, health and non-somker donors were constructed. A gamma ray source of 60Co was used and doses of 0, 2.5, 5 and 7 Gy were delivered to blood cells. The results show good correlation (R2 = 0.973, SD = 0.009) between the radiation dose and DNA damage as measured by the parameter Tail Intensity (percentage of DNA in the tail of the "comet"). Furthermore, we observe the variability in predicting DNA damage by Gy (7.59, SD = 1.5). Potential use of this technique in the biological dosimetry of ionizing radiations is being evaluated.
Keywords: Alkaline comet assay; Biological radiation effects; DNA damages; Radiation doses; Radioinduction
Introducción
La electrofores si de células individuales en gel de agarosa (SCGE), conocida como Ensayo Cometa, es un método muy difundido, rápido y sensible, capaz de estimar diversos niveles de daño en el ADN, principalmente rupturas de simple y doble hebra. Esta técnica, diseñada por Östlin y Johanson en 1984 [1] combina la electroforesis de células eucariotas individuales y tratamientos de lisis con los cuales se evidencian los fragmentos de ADN originados por daño genotóxico que se cuantifican gracias al análisis de imágenes en un ordenador.
La versatilidad del ensayo cometa ha permitido su introducción en diversos campos, entre ellos, la dosimetría biológica de radiaciones ionizantes [2] donde se puede aplicar como un ensayo alternativo para estimar dosis absorbidas cuando las técnicas convencionales se vean limitadas, como es el caso de exposición a dosis muy elevadas, irradiación intensamente focalizada [3], el triaje de los afectados en las emergencias radiológicas [4], monitoreo de personal expuesto [5], evaluación de radiosensibilidad [6] y otras.
En efecto, las investigaciones experimentales con el ensayo cometa han demostrado su capacidad de detección de daño por diversas fuentes energéticas [7] con clara relación dosis-efecto y límites de detección variables, generalmente en el rango de dosis desde 0.5 Gy hasta 10 Gy. Sin embargo, la falta de consenso y estandarización del protocolo [8] han contribuido a generar discrepancias de
valores reportados por diferentes laboratorios [9], incluso cuando las condiciones fueron controladas y homogéneas.
En ese sentido, A. Collins entre otros [10,11,12] han recomendado que una forma de mitigar este problema y facilitar la aplicación de esta metodología es a través de la construcción de curvas de calibración dosis-efecto con radiación ionizante para establecer el nivel de correlación propio de un laboratorio, normalizar resultados con respecto a ella y generar controles internos.
En el presente estudio nos proponemos evaluar el ensayo cometa alcalino en condiciones experimentales por medio de irradiación gamma en linfocitos y monocitos aislados de sangre periférica de personas aptas, como una forma de contribuir a la implementación de la técnica y generar un estudio de base para próximas investigaciones.
Materiales y Métodos
Materiales utilizados
Para este trabajo se utilizaron como insumos la agarosa de bajo punto de fusión y agarosa de alto punto de fusión (SERVA), Ficoll Histopaque 1077 y medio de cultivo RPMI 1640 (SIGMA); NaOH, EDTA, NaCl, Tritón X100 y Tris (MERCK) y SYBR Gold (INVITROGEN). Los equipos empleados fueron cámara de electroforesis con fuente de voltaje Powerpac (BIORAD). Las irradiaciones se hicieron con una fuente de 60Co montada en un equipo de teleterapia marca Theraton Phoenix. Las observaciones visuales y fotografías se hicieron con un microscopio Meiji Techno MT6000 acoplado a una videocámara Allied Stingray.
Toma de muestra sanguínea y aislamiento de células mononucleares
Previo consentimiento informado, se tomó 6 ml de sangre venosa en tubos heparinizados, de cuatro donantes aparentemente sanos, no fumadores y sin historial de exposición a radiación (2 masculinos y 2 femeninos, con edades comprendidas entre los 26 y 36 años) los tubos fueron inmediatamente cubiertos con papel aluminio para proteger la muestra de la luz y mantenidos en refrigeración hasta su procesamiento por un tiempo no mayor a 30 minutos.
El aislamiento de células mononucleares se realizó mediante separación por gradientes de densidad con el Ficoll. Brevemente, la sangre se diluyó con igual volumen de medio de cultivo frío RPMI 1640. La mezcla se homogeneizó y con una pipeta serológica se repartió cuidadosamente en dos tubos de 15 ml, cada uno conteniendo 6 ml de Ficoll. Los tubos se centrifugaron a 400 g durante 15 minutos.
Las células mononucleares (linfocitos y monocitos) observadas en la interface entre el Ficoll y el plasma fueron aspiradas con una micropipeta y dispensadas en otro tubo con 10 ml de RPMI frío. Se procedió a invertir el tubo y se centrifugó a 250 g por 7 min. Finalmente, se decantó el sobrenadante. El pellet fue re suspendido en RPMI frío y se evaluó la cantidad y viabilidad de las células mononucleares aisladas. Lo recomendable es ajustar a 106 células/ml con una viabilidad mayor de 95 %.
Irradiación
La suspensión de células aisladas se distribuyó equitativamente en cuatro tubos (uno para cada dosis) Eppendorf de 2 ml y se trasladaron en cadena de frío al Laboratorio Secundario de Calibraciones Dosimétricas (LSCD) para su irradiación a temperatura ambiente.
Se irradiaron las muestras con rayos gamma provenientes de una fuente de Co-60 a dosis de 0, 2.5, 5 y 7 Gy, con una tasa de dosis de 0,656 Gy/min. A continuación, los tubos con las muestras se transportaron a nuestro laboratorio en cadena de frío para continuar su procesamiento.
Ensayo cometa
Para llevar a cabo el ensayo cometa, adoptamos las condiciones propuestas por el ECVAG (The European Comet Assay Validation Group) previamente verificado, bajo nuestras condiciones. Brevemente, se embebió10 μl de la suspensión de células en 100 μl de agarosa de bajo punto de fusión 0.7 % a 37 °C, luego de mezclar suavemente, se dispensó todo el volumen, en 2 gotas (50
μl) separadas, sobre una lámina portaobjetos previamente cubierta con una fina capa de agarosa normal 0.5 %. Se colocó cubre-objetos y dejó solidificar protegido de la luz en refrigeración por 10 min. Se prepararon tres láminas por cada dosis.
Luego de retirar los cubreobjetos, se sumergieron todas las láminas en solución de lisis (NaCl 2,5 M, Tris 10 mM, EDTA 0.1 M y 1 % de Tritón X-100, pH a 10) durante una hora, en frío. Cumplido el tiempo, se realizaron dos lavados de 5 min cada uno con agua desionizada para después desnaturalizar el ADN con la solución de electroforesis (NaOH 0,3 M, EDTA 1 mM, pH 13) por 20 min. Finalmente, se ejecutó la corrida electroforética con la misma solución por 20 min a 25 V (1,25 V/cm) y 300 mA. Luego de ello, los portaobjetos se neutralizaron en buffer tampón (Tris 0,4 M, 7.5 pH) durante 5 min y se fijaron en etanol 70 % por 5 min para su almacenamiento.
Análisis de cometas
El análisis de las láminas preparadas fue realizado en el Centro Nacional de Salud Ocupacional y Protección del Ambiente para la Salud – CENSOPAS (Lima-Perú). Se rehidrataron los geles con la solución de neutralización por 10 min, luego se procedió a cubrir los portaobjetos con 500 μl de solución de tinción SYBR Gold 1X por 15 min.
Cada lámina fue examinada a 200x con un microscopio de epifluorescencia acoplado a una videocámara y un software de análisis (Comet Assay IV; Perceptive Instrument). Se obtuvo 100 nucleoides al azar por cada gel preparado, que fueron analizados con el parámetro Tail Intensity (porcentaje de ADN en la cola) para estimar el daño. Se aplicó la estadística descriptiva no paramétrica para procesar los datos.
Resultados y discusión
Como se aprecia en la Figura 1, las curvas revelan la relación lineal entre el parámetro Tail Intensity (% de ADN en la cola) y las dosis de radiación gamma, en el intervalo señalado. Asimismo, en las imágenes de los nucleoides (cometas) representativos por cada dosis de irradiación (Figura 2) muestra el incremento de las “colas” a medida que se incrementan las dosis. Aunque, también se puede notar la divergencia entre las curvas, la cual es más evidente a altas dosis.
En base al análisis de regresión se obtuvo los coeficientes de correlación (R2) y las ecuaciones de curva, estas últimas se emplearon para predecir, el daño producido por Gray de irradiación gamma. De los resultados (Tabla 1) se desprenden los promedios de coeficientes de correlación; R2 = 0.973, SD = 0.009. De igual manera para el daño estimado por Gray de radiación se calcula en 7.59, SD
=1.5.
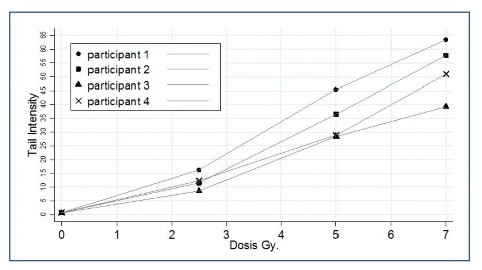
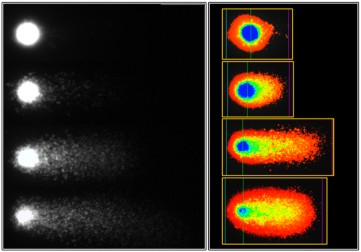
Figura 2. Las imágenes muestran la apariencia de los “cometas” por cada dosis de irradiación, captada por la videocámara en escala de grises (izquierda) y convertida, al formato digital con el software Comet Assay IV (derecha).
Tabla 1. Coeficientes de correlación y predicción de daño por 1 Gy de dosis de irradiación gamma, en cada curva construida.
R2 | Predicción de daño por 1 Gy [95 % CI] | ||
Participante 1 | 0.986 | 9.241758 | [5.92 ‐ 12.56] |
Participante 2 | 0.968 | 8.292606 | [3.69 ‐ 12.89] |
Participante 3 | 0.974 | 5.77164 | [2.89 ‐ 8.64] |
Participante 4 | 0.965 | 7.056855 | [2.96 ‐ 11.15] |
De acuerdo con lo esperado, los valores de los coeficientes de correlación indican buen ajuste de curva y dependencia lineal entre las variables, similar a lo hallado en otros laboratorios, como en el ejercicio de intercomparación del ECVAG 2014[9] donde 13 laboratorios participantes reportaron valores por encima de 0.97. Por su parte, Pitozzy et al. [13] encontraron resultados parecidos (R2=0.99) al irradiar tanto con rayos gamma (60Co) como con rayos X. Por otro lado, Wang et al. [4] obtuvo un R2 = 0.9979 con ajuste polinomial de la curva, al evaluar 7 puntos de dosis.
Respecto a la variación, se manifiesta por las diferencias en las pendientes delas curvas que se ven reflejadas en la estimación de daño por dosis de radiación. Es razonable asumir dicha variación como característica inherente del método [14]. Aunque se hayan mantenido condiciones estandarizadas, la técnica posee muchos puntos críticos [15] que son susceptibles a inducir sesgo más aun cuando se ejecutan en diferentes días.
Sin embargo, no se descartan otros factores que también pudieran influir como las características individuales de los participantes. Como la radiosensibilidad [16] que es una condición individual importante estimada en 9 % de la población [17] y que altera los resultados en el ensayo cometa [18]. También se ha demostrado que la ocupación, la alimentación [19], incluso el clima [20,21] son elementos que contribuyen. Entre las fuentes externas de error se ha visto que la irradiación igualmente podría estar implicada [22].
Conclusiones
La construcción de curvas dosis efecto con el ensayo cometa permitió evidenciar la cinética del efecto producido por las dosis de radiación en las células vivas presentándose una clara correlación dosis-efecto, así como la variabilidad. Contando con las fuentes de radiaciones que tiene el IPEN, en futuros estudios se podrían desarrollar otras curvas dosis-efecto con líneas celulares en condiciones estandarizadas.
Referencias
[1] Östling O, Johanson KJ. Microelec-trophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem. Biophys. Res. Commun.1984; 123, 291–298.
[2] Olive PL. Impact of the comet assay in radiobiology. Mutat Res. 2009; 681(1): 13–23.
[6]. Güerci A, Zúñiga L, Marcos R. Construction and validation of a dose-response curve using the comet assay to determine human radiosensitivity to ionizing radiation. J Toxicol Environ Health A. 2011; 74(15-16): 1087–93.
[7] Rössler U, Hornhardt S, Seidl C, Müller-Laue E, Panzer W, Schmid E, et al. The sensitivity of the alkaline comet assay in detecting DNA lesions induced by X rays, gamma rays and alpha particles. Radiat Prot Dosimetry. 2006; 122(1-4): 154–9.
[8] Forchhammer L, Johansson C, Loft S, Möller L, Godschalk RW, Langie SA, et al. Variation in the measurement of DNA damage by comet assay measured by the ECVAG inter-laboratory validation trial. Mutagenesis. 2010; 25(2):113–23.
[9] Godschalk RW, Ersson C, Stępnik M, Ferlińska M, Palus J, Teixeira JP, et al. Variation of DNA damage levels in peripheral blood mononuclear cells isolated in different laboratories. Mutagenesis. 2014; 29(4): 241–249.
[10] Langie SAS, Azqueta A, Collins AR. The comet assay: Past, present, and future. Front Genet. 2015 Aug; 6: 1–3.
[12] Johansson C, Møller P, Forchhammer L, Loft S, Godschalk RWL, Langie SAS, et al. An ECVAG trial on assessment of oxidative damage to DNA measured by the comet assay. Mutagenesis. 2010; 25(2): 125–32.
[13] Pitozzi V, Pallotta S, Balzi M, Bucciolini M, Becciolini A, Dolara P, et al. Calibration of the comet assay for the measurement of DNA damage in mammalian cells. Free Radic Res. 2006; 40(11):1149-54.
[15] Sirota NP, Zhanataev AK, Kuznetsova EA, Khizhnyak EP, Anisina EA, Durnev AD. Some causes of inter-laboratory variation in the results of comet assay. Mutat Res Genet Toxicol Environ Mutagen. 2014; 770: 16-22.
[16] Greve B, Bölling T, Amler S, Rössler U, Gomolka M, Mayer C, et al. Evaluation of different biomarkers to predict iIndividual radiosensitivity in an inter-laboratory comparison- lessons for future studies. PLoS One. 2012;7(10): e47185.
[17] Scott D, Barber JB, Levine EL,Burril W, Roberts SA.. Radiation-induced micronucleus induction in lymphocytes identifies a high frequency of radiosensitive cases among breast cancer patients: a test for predisposition? Br J Cancer. 1998; 77(4): 614-20.
[18] Shahidi M, Mozdarani H, Bryant PE. Radiation sensitivity of leukocytes from healthy individuals and breast cancer patients as measured by the alkaline and neutral comet assay. Cancer
[19] Kažimírová A, Barančoková M, Volkovová K, Staruchová M, Krajčovičová-Kudláčková M, Wsólová L, et al. Does a vegetarian diet influence genomic stability? Eur J Nutr. 2004 Feb; 43(1): 32–8.
[20] Dušinská M, Vallová B, Ursı́nyová M, Hladı́ková V, Smolková B, Wsólová L, et al. DNA damage and antioxidants; fluctuations through the year in a central European population group. Food Chem Toxicol. 2002; 40(8): 1119–23.
[21] Lebailly P, Vigreux C, Lechevrel C, Ledemeney D, Godard T, Sichel F, et al. DNA damage in mononuclear leukocytes of farmers measured using the alkaline comet assay: discussion of critical parameters and evaluation of seasonal variations in relation to pesticide exposure. Cancer Epidemiol Prev Biomarkers. 1998;7(10): 917-27.
[22] Azqueta A, Collins AR. The essential comet assay: A comprehensive guide to measuring DNA damage and repair. Arch Toxicol. 2013; 87(6): 949–68.